 欢迎访问中南医学期刊社系列期刊网站!
欢迎访问中南医学期刊社系列期刊网站!
目的 构建基于遗传算法误差反向传播(GA-BP)人工神经网络的阿立哌唑(APZ)及其代谢产物脱氢阿立哌唑(DAPZ)血药浓度预测模型,为需要调整APZ使用剂量或不能进行APZ血药浓度监测的患者提供浓度预测模型。
方法 回顾性收集在2021年7月—2022年8月新疆维吾尔自治区人民医院就诊且规律服用APZ的174例患者的血药浓度资料,提取相关变量,采用Matlab R2018a编程软件,结合深度学习网络构建GA-BP人工神经网络预测模型,预测APZ+DAPZ血药浓度。
结果 GA-BP人工神经网络预测模型验证结果显示,35例验证组样本的预测结果与实测结果相比,平均预测误差为-0.092 6,平均绝对误差为0.689 5,35个预测误差均小于15%,小于15%的概率为100%,血药浓度的预测值与实测值之间的相关系数为0.997,预测结果较理想。
结论 GA-BP人工神经网络预测模型预测APZ+DAPZ血药浓度,可用于APZ的个体化给药。
阿立哌唑(aripiprazole,APZ)是第二代喹啉酮类非典型抗精神病药,主要用于治疗精神分裂症、双相情感障碍、重性抑郁障碍、与自闭症相关的过敏性障碍和抽动秽语障碍[1],还可作为心境稳定剂用于情感障碍、强迫症、躯体形式障碍、老年痴呆等[2]。该药已在全球多个国家广泛使用,包括美国、韩国、日本和中国等[3]。由于APZ可部分激动多巴胺D2受体,稳定多巴胺水平,也是5-羟色胺受体的部分激动剂和拮抗剂[4],具有较好的安全性和有效性,因此较典型抗精神病药物具有明显优势。有研究认为,APZ药动学差异大,易受合并用药的影响[5]。因此,临床使用 APZ时需进行血药浓度监测,以实施个体化给药。新疆位于中亚腹地,是一个多民族聚居地,少数民族人口众多,各民族间可能存在吸收代谢关键基因的变异[6]。且新疆维吾尔自治区许多基层医疗机构无法开展血药浓度监测工作,故建立APZ血药浓度预测模型对新疆维吾尔自治区基层医疗机构抗精神疾病个体化治疗就显得尤为重要。
近年来,应用神经网络模拟药动学过程已成为研究的热点,在药物预测领域受到青睐[7]。本研究借助Matlab R2018a编程软件和SPSS 23.0软件,以新疆维吾尔自治区使用APZ患者的全血浓度数据为分析对象,建立适合APZ个体化给药的前瞻性预测模型,初步为需要调整APZ使用剂量或无法进行血药浓度监测的患者提供血药浓度预测,从总体上提高新疆维吾尔自治区抗精神类疾病的合理用药水平,也为临床快速、有效制定APZ个体化给药方案提供依据。
1 资料与方法
1.1 研究对象
回顾性收集2021年7月—2022年8月就诊于新疆维吾尔自治区人民医院,服用APZ治疗的174例患者资料,均符合以下纳排标准。 纳入标准 :①严格遵守医嘱或本研究要求规律口服APZ;② 定期监测APZ血药浓度;③研究期间未接受透析或利尿等显著影响药物消除的治疗措施。排除标准:①采集血样时间点不符合要求;②末次服药时间不明确;③相关研究资料不全或缺失。
利用Microsoft Excel软件生成随机数,按8 ∶ 2的比例将调查样本随机分为建模组(139例)和验证组(35例)。本研究方案经新疆维吾尔自治区人民医院医学伦理委员会批准(批件号:XJS2021052602),并获得患者知情同意。
1.2 研究方法
1.2.1 APZ血药浓度测定
所有患者均规律于每日晚饭后30 min内口服 APZ口崩片(都康弘药业集团股份有限公司,批号:1F012,规格:5 mg/片),1次/d。给药剂量为2.5~30.0 mg·d-1。患者均于检测日当天上午9: 00~11: 00空腹抽取静脉血2~3 mL,-4℃条件下离心5 min(2 480×g),精密吸取30 µL血清样本,置于1.5 mL聚乙烯离心管中,加入样本前处理蛋白沉淀剂300 µL,涡旋震荡1 min,-4℃条件下离心5 min(24 359×g),取上清液50 µL,加入450 µL超纯水,震荡1 min,过滤,测定APZ与脱氢阿立哌唑(dehydro aripiprazole,DAPZ)的谷浓度。
1.2.2 输入变量和输出变量的确定
根据临床研究并结合相关文献资料[8-12],筛选可能影响APZ+DAPZ血药浓度的因素。以APZ+DAPZ血药浓度为输出变量,并以患者年龄、性别、民族、身高、体重、身体质量指数、服药剂量、服药天数、合并用药、白细胞计数(WBC)、中性粒细胞计数(NE)、红细胞计数(RBC)、血红蛋白(HGB)、血小板计数(PLT)、总蛋白(TP)、白蛋白(Alb)、球蛋白(Glb)、总胆红素(TBIL)、γ-谷胺酰转肽酶(GGT)、天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、碱性磷酸酶(AKP)、尿素氮(BUN)和血肌酐(Scr)为指标,作为遗传算法误差反向传播(GA-BP)人工神经网络预测模型的输入变量。
1.2.3 数据预处理
在进行网络训练之前将数据进行预处理。其中:①服药天数变量赋值:服药天数≤3 d为0,3 d<服药天数≤6 d为1,6 d<服药天数≤9 d为2,9 d<服药天数≤12 d为3,12 d<服药天数≤15 d为4,服药天数>15 d为5;②性别变量赋值:男性为0,女性为1;③合并用药变量赋值:不合并用药或合并不影响APZ代谢的药物为0,合并CYP2D6、CYP3A4诱导剂如丙戊酸钠、利培酮、喹硫平、卡马西平为1,合并CYP2D6、CYP3A4抑制剂如盐酸氟西汀、盐酸帕罗西汀为2;④民族变量赋值:汉族为0,维吾尔族为1,其他民族为2。
其他输入变量作归一化处理,以消除不同因素之间由于数值差异造成的误差,利用Matlab R2018a编程软件的Mapminmax函数将原始数据归一到[0,1]。
1.2.4 GA-BP人工神经网络模型的建立
采用Matlab R2018a编程软件编码实现遗传算法,构建初始化种群,优化BP神经网络。进一步获得初始权值、阈值,经过GA优化后按BP网络算法学习。GA-BP人工神经网络预测流程图见图1。
设置构建参数,隐含层节点个数初始确定为18,初始学习率为0.01,动量系数为0.90,最大训练次数为1 000,迭代次数为6 000,其他参数为默认值。根据作用函数,按既定学习规则自动调节各层节点之间的连接权重,进行迭代,以使网络的实际输出值与目标值之间的误差小于3.0%。经多次调试,直至获得最佳预测精度(训练集预测精度与测试集预测精度接近)时,固定最优权重,即可进行APZ的血药浓度预测。
1.2.5 模型验证
为检验模型性能,GA-BP人工神经网络模型建好后,预测未参加建模的验证组患者的APZ血药浓度,考察在两种方法下APZ血药浓度估算值与实测值的相关性,并绘制相关性散点图。同时计算预测误差(prediction error,PE),以平均预测误差(mean prediction error,MPE)和PE超过±15% 的样本数评价模型预测的准确度,MPE越小,则预测的准确度越好;以平均预测绝对误差(mean absolute prediction error,MAE)评价模型预测的精密度,MAE越小,则模型预测的精密度越好[14]。相关计算公式如下[15]:
PE=Concpredicted-ConcActual
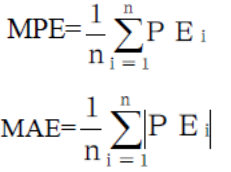
1.3 统计学分析
利用SPSS 23.0软件进行统计分析,用One -Sample Kolmogorov-Smirnov test考察数据是否正态分布,连续性变量采用x±s表示,用两独立样本t检验比较建模组与验证组差异;分类变量采用n(%)表示;用χ2检验比较建模组与验证组差异,P<0.05为差异有统计学意义。
2 结果
2.1 患者的基本资料
两组患者的性别、年龄等基本资料差异均无统计学意义(P>0.05),具有可比性。结果见表1。
2.2 血药浓度预测模型的建立
将139例患者样本作为训练组用于构建模型,将“1.2.2”项下筛选过后的与APZ+DAPZ血药浓度存在相关性的24个变量因素作为网络的输入数据,口服APZ患者的血药浓度作为网络的输出数据,建立一个3层的BP网络。经过多次调试,最终确定GA-BP人工神经网络参数为:隐含层节点个数初始确定为18,初始学习率为0.001,动量系数为0.90,学习率下降率为0.2,最大训练次数为1 000,迭代次数为6 000,训练目标为0.000 1,其他参数为默认值,构建GA-BP人工神经网络模型。
2.3 模型验证
用建立好的模型预测未参加建模的35例患者APZ+DAPZ血药浓度,将其与实际测定浓度进行比较。结果显示:验证组35个浓度的PE均小于±15%,所占比率为100%,MAE为0.689 5,MPE为-0.092 6。结果见表2和图2。
2.5 预测值与实测值的相关性分析
患者口服APZ后血药浓度实测值和预测值之间的相关系数为0.997。血药浓度预测值和实测值之间相关性较高,预测患者APZ+DAPZ血药浓度结果较理想。结果见图3。
3 讨论
APZ是目前临床常用的抗精神疾病的药物,相较于典型或第一代抗精神病药物(氯氮平、氟哌啶醇等)具有较好的安全性和有效性[12]。APZ在临床使用中个体差异较大,血药浓度影响因素较多[16]。因此服用APZ的患者需要通过定期监测血药浓度调整给药剂量,从而确保用药的安全、有效。临床医师往往需要根据血药浓度监测结果,反复调整APZ剂量,以期达到有效浓度范围。若能在调整APZ剂量后,即可迅速预测该剂量下的稳态血药浓度,无疑有助于临床预测最佳用药剂量,以尽快达到APZ治疗窗。本研究收集了规律服用APZ的174例患者临床资料,收集可能影响血药浓度的24个影响因素与APZ+DAPZ血药浓度建立遗传算法误差反向传播(GA-BP)人工神经网络预测模型,为需要调整APZ 使用剂量或无法进行血药浓度监测的患者提供血药浓度预测。
人工神经网络法与传统分析方法相比,避免了必须依赖于已知模型的弊端,具有独特优势[17]。自1991年Hussain等[18]首次提出人工神经网络可用于药动学领域的设想之后,人们对此进行了不懈的研究与实践。Yamamura等[19]利用人工神经网络模型来预测烧伤患者的血浆氨基糖苷浓度。张晨等[7]应用GA-BP人工神经网络预测丙戊酸钠血药浓度。赵婷等[20]基于人工神经网络预测新疆维吾尔族癫痫患儿奥卡西平血清浓度。这些研究都能够较好地服务于临床,为临床合理用药提供依据。本研究采用GA-BP人工神经网络法构建APZ血药浓度预测模型,并对预测模型进行验证,模型验证结果显示,GA-BP人工网络可用于新疆维吾尔自治区患者口服APZ后血药浓度的前瞻性预测研究,促进临床个体化合理用药。并希望能将其推广应用于无法开展治疗药物浓度监测的基层医疗机构以及无能力定期进行治疗药物浓度测定的患者,整体提高新疆地区抗精神治疗合理用药水平。
此外,新疆少数民族人口众多,其中以维吾尔族人口最多[21],与汉族人群不同,维吾尔族人群拥有西部欧亚特定的单倍群比例是42.6%[22],生活习惯、遗传背景也与汉族人群有所不同,因此新疆维吾尔自治区患者在临床使用APZ时,一般需进行血药浓度监测,实施个体化给药。本研究存在的不足是变量中未引入代谢基因型,根据相关研究,患者CYP2D6基因型对APZ血药浓度影响较大[23]。有学者研究发现,在具有功能性CYP2D6等位基因的患者与具有1个或2个非功能性CYP2D6等位基因的患者中,DAPZ浓度分别为35%或22%,可见CYP2D6基因型对APZ和DAPZ的活性值均有显著影响[24]。有研究报道,不同表型的 APZ 和 DAPZ 血药浓度总水平遵循超快速代谢者<强代谢者<中间代谢者<弱代谢者的趋势;其中APZ 的血药浓度在强代谢者和中间代谢者之间差异有统计学意义,但中间代谢者和弱代谢者之间差异无统计学意义[25]。因此,在这些方面有待扩大样本量进一 步研究。
1.Tandon R, Keshavan MS, Nasrallah HA. Schizophrenia, "just the facts" what we know in 2008. 2. Epidemiology and etiology[J]. Schizophr Res, 2008, 102(1-3): 1-18. DOI: 10.1016/j.schres.2008.04.011.
2.吴金丽. 阿立哌唑的临床应用[J]. 医学信息, 2018, 31(14): 42-45. [Wu JL. Clinical application of aripiprazole[J]. Medical Information, 2018, 31(14): 42-45.] DOI: 10.3969/j.issn.1006-1959.2018.14.014.
3.Cuomo A, Goracci A, Fagiolini A. Aripiprazole use during pregnancy, peripartum and lactation. A systematic literature search and review to inform clinical practice[J]. J Affect Disord, 2018, 228: 229-237. DOI: 10.1016/j.jad.2017.12.021.
4.Fleishhacker WW. New developments in the pharmacotherapy of schizophrenia[J]. J Neural Tmnsm Suppl, 2003, (64): 105-117. DOI: 10.1007/978-3-7091-6020-6_7.
5.Kiss Á, Menus Á, Tóth K, et al. Phenoconversion of CYP2D6 by inhibitors modifies aripiprazole exposure[J]. Eur Arch Psychiatry Clin Neurosci, 2020, 270(1): 71-82. DOI: 10.1007/s00406-018-0975-2.
6.付真彦. 新疆地区汉族、维吾尔族、哈萨克族胆固醇吸收代谢关键基因的变异与功能[D]. 北京: 中国科学院大学, 2017.
7.张晨, 倪穗琴, 温预关, 等. 应用GA-BP人工神经网络预测丙戊酸钠血药浓度[J]. 今日药学, 2014, 24(1): 7-10. [Zhang C, Ni SQ, Wen YG, et al. Prediction of serum sodium valproate concentration with GA-BP artificial neural network model[J]. Pharmacy Today, 2014, 24(1): 7-10.] DOI: CNKI:SUN:YAXU.0.2014-01-006.
8.Hiemke C, Bergemann N, Clement HW, et al. Consensus guidelines for therapeutic drug monitoring in neuropsychopharmacology: update 2017[J]. Pharmacopsychiatry, 2018, 51(1-02): e1. DOI: 10.1055/s-0037-1600991.
9.Patteet L, Morrens M, Maudens KE, et al. Therapeutic drug monitoring of common antipsychotics[J]. Ther Drug Monit, 2012, 34(6): 629-651. DOI: 10.1097/FTD.0b013e3182708ec5.
10.Wang JS, Zhu HJ, Donovan JL, et al. Aripiprazole brain concentration is altered in P-glycoprotein deficient mice[J]. Schizophr Res, 2009, 110(1-3): 90-94. DOI: 10.1016/j.schres.2009.01.011.
11.Harrison TS, Perry CM. Aipiprazole: a review of its use in schizophrenia and schizoaffective disorder[J]. Drugs, 2004, 64(15): 1715-1736. DOI: 10.2165/00003495-200464150-00010.
12.Shastry CS, Shafeeque AA, Ashwathnarayana BJ. Effect of combination of aripiprazole with carbamazepine and fluvoxamine on liver functions in experimental animals[J]. Indian J Pharmacol, 2013, 45(2): 121-125. DOI: 10.4103/0253-7613.108280.
13.马雪, 李红健, 赵婷, 等. 利用GA-BP神经网络预测新疆癫痫患儿拉莫三嗪血药浓度[J]. 新疆医学, 2022, 52(7): 847-851. [Ma X, Li HJ, Zhao T, et al. Application of GA-BP neural network on prospective prediction about the serum concentration of lamotrigine in children with epilepsy in Xinjiang[J]. Xinjiang Medical Journal, 2022, 52(7): 847-851.] http://qikan.cqvip.com/Qikan/Article/Detail?id=00002EOKK77G7JP0MLDO2JP06NR.
14.陈明, 主编. MAT- LAB神经网络原理及实例的精细化解[M].北京: 清华大学出版社, 2013: 156-177.
15.Royston P, Parmar MK, Sylvester R. Construction and validation of a prognostic model across several studies, with an application in superficial bladder cancer[J]. Stat Med, 2004, 23(6): 907-926. DOI: 10.1002/sim.1691.
16.李琰, 瞿发林, 汪莉, 等. 阿立哌唑血清药物浓度/剂量比影响因素研究[J]. 中国药师, 2022, 25(3): 455-457. [Li Y, Qu FL, Wang L, et al. Study on the Influencing factors in serum drug concentration/dose ratio of aripiprazole[J]. China Pharmacist, 2022, 25(3): 455-457.] DOI: 10.19962/j.cnki.issn10 08-049X.2022.03.012.
17.Kang SH, Poynton MR, Kim KM, et al. Population pharmacokinetic and pharmacodynamic models of remifentanil in healthy volunteers using artificial neural network analysis[J]. Br J Clin Pharmacol, 2007, 64(1): 3-13. DOI: 10.1111/j.1365-2125.2007.02845.x.
18.Hussain AS, Yu XQ, Johnson RD. Application of neural computing in pharmaceutical product development[J]. Pharm Res, 1991, 8(10): 1248-1252. DOI: 10.1023/a:1015843527138.
19.Yamamura S, Kawada K, Takehira R, et al. Prediction of aminoglycoside response against methicillin-resistant Staphylococcus aureus infection in burn patients by artificial neural network modeling[J]. Biomed Pharmacother, 2008, 62(1): 53-58. DOI: 10.1016/j.biopha.2007.11.004.
20.赵婷, 李红健, 翁振群, 等. 基于人工神经网络的新疆维吾尔族癫痫患儿奥卡西平血清浓度预测研究[J]. 中国药学杂志, 2020, 55(16): 1376-1380. [Zhao T, Li HJ, Weng ZQ, et al. Prediction of serum concentration of oxasepine in Xinjiang Uygur children with epilepsy based on artificial neural network[J]. Chinese Pharmaceutical Journal, 2020, 55(16): 1376-1380.] DOI: 10.11669/cpj.2020.16.012.
21.王婷婷, 李红健, 贾莉, 等. 维吾尔族癫痫患儿奥卡西平活性代谢产物血药浓度监测分析[J]. 中国医院药学杂志, 2016, 36(8): 644-646. [Wang TT, Li HJ, Jia L, et al. Analysis of the influencing factors of the plasma concentration of oxcarbazepine active metabolite in Uygur children with epilepsy[J]. Chinese Journal of Hospital Pharmacy, 2016, 36(8): 644-646.] DOI: 10.13286/j.cnki.chinhosppharmacyj.2016.08.11.
22.Yao N, Huang S, Huang A, et al. Analysis of influencing factors on monohydroxylated derivative of oxcarbazepine plasma concentration in children with epilepsy[J]. Eur J Clin Pharmacol, 2022, 78(10): 1667-1675. DOI: 10.1007/s00228-022-03373-4.
23.Jukic MM, Smith RL, Haslemo T, et al. Effect of CYP2D6 genotype on exposure and efficacy of risperidone and aripiprazole: a retrospective, cohort study[J]. Lancet Psychiatry, 2019, 6(5): 418-426. DOI: 10.1016/S2215-0366(19)30088-4.
24.Hendset M, Hermann M, Lunde H, et al. Impact of the CYP2D6 genotype on steady-state serum concentrations of aripiprazole and dehydroaripiprazole[J]. Eur J Clin Pharmacol, 2007, 63(12): 1147-1151. DOI: 10.1007/s00228-007-0373-6.
25.Zhang X, Xiang Q, Zhao X, et al. Association between aripiprazole pharmacokinetics and CYP2D6 phenotypes: a systematic review and meta-analysis[J]. J Clin Pharm Ther, 2019, 44(2): 163-173. DOI: 10.1111/jcpt.12780.